¡Estamos encantados de tenerte aquí explorando el emocionante mundo de los enlaces iónicos!
En este sitio, descubrirás todo lo que necesitas saber sobre cómo funcionan estos fascinantes ENLACES IÓNICOS que mantienen unidos a muchos compuestos.
¿Qué son los enlaces iónicos?
Son un tipo de enlaces químicos que se forma entre átomos con diferencias significativas de electronegatividad, generalmente un metal y un no metal. En este tipo de enlace, los átomos transfieren electrones para formar iones cargados eléctricamente que se atraen entre sí debido a la fuerza electrostática
Formación y propiedades de los compuestos iónicos
Formación de compuestos iónicos
Estos compuestos se forman cuando átomos de diferentes elementos ganan o pierden electrones para adquirir una configuración electrónica estable similar a la de un gas noble. Esto resulta en la formación de iones cargados positiva (cationes) y negativamente (aniones) que se atraen electrostáticamente entre sí.
Transferencia de Electrones: En la formación de compuestos iónicos, uno o más átomos pierden electrones para convertirse en iones positivos (cationes), mientras que otros átomos ganan electrones para convertirse en iones negativos (aniones). Esta transferencia de electrones se produce debido a las diferencias significativas en la electronegatividad entre los elementos.
Cristalización: Los iones positivos y negativos se organizan en una estructura tridimensional regular llamada red cristalina. En esta red, los iones de carga opuesta están dispuestos alternativamente y se mantienen unidos por fuerzas electrostáticas.
Propiedades de los compuestos iónicos
- Puntos de Fusión y Ebullición Elevados: Los compuestos iónicos suelen tener puntos de fusión y ebullición elevados debido a las fuertes fuerzas electrostáticas entre los iones en la red cristalina. Para fundirlos o vaporizarlos, es necesario proporcionar suficiente energía para romper estas fuerzas.
- Solubilidad en Agua: Muchos compuestos iónicos son solubles en agua debido a la capacidad del agua para disociar los iones y formar soluciones acuosas conductoras. Sin embargo, algunos compuestos iónicos son insolubles en agua debido a las fuerzas interiónicas más fuertes que las interacciones con el agua.
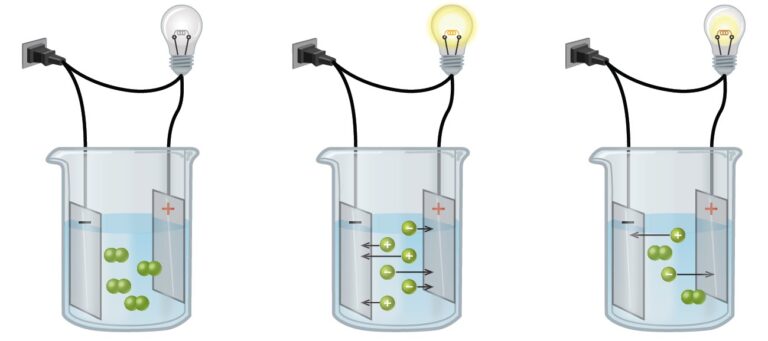
- Conductividad Eléctrica: Los compuestos iónicos sólidos no conducen electricidad porque los iones están fijos en la red cristalina y no pueden moverse. Sin embargo, cuando se disuelven en agua o se funden, los iones se liberan y pueden moverse libremente, lo que hace que la solución o el líquido resultante sean conductores de electricidad.
- Dureza: Los compuestos iónicos suelen ser duros y quebradizos debido a las fuerzas de atracción electrostática entre los iones en la red cristalina. Al aplicar una fuerza externa, las capas de iones pueden deslizarse fácilmente una sobre la otra, lo que resulta en una fractura cristalina.


Redes Cristalinas
Cuando los compuestos iónicos se forman a través del enlace iónico, los iones positivos y negativos se organizan en una estructura tridimensional ordenada llamada red cristalina. Esta estructura cristalina se repite en todas las direcciones en el sólido, formando un cristal.
Características
- Orden y Repetición: Las redes cristalinas exhiben un alto grado de orden y repetición en todas las direcciones. Cada ion positivo está rodeado por iones negativos y viceversa, formando una estructura tridimensional regular.
- Simetría: Estas redes pueden tener diferentes tipos de simetría, dependiendo de la disposición de los iones en la estructura. Algunos ejemplos comunes de sistemas cristalinos son cúbico, tetragonal, ortorrómbico, hexagonal y trigonal.
- Puntos de Coordinación: Cada ion en una red cristalina tiene un número específico de iones vecinos más cercanos, conocidos como puntos de coordinación. Este número está determinado por la geometría de la red cristalina y la disposición de los iones.
- Empaquetamiento Compacto: Las redes tienden a adoptar configuraciones que minimizan la energía y maximizan el empaquetamiento de los iones. Esto puede resultar en estructuras cristalinas densas y compactas.
Propiedades
Las propiedades de los compuestos iónicos, como la dureza, el punto de fusión y la solubilidad, están influenciadas en gran medida por la estructura de la red cristalina. Por ejemplo, las redes cristalinas más compactas suelen tener puntos de fusión más altos y ser más duras debido a las fuerzas de atracción más fuertes entre los iones.
Estructura
Las redes cristalinas en los compuestos iónicos se caracterizan por su disposición tridimensional ordenada de iones positivos y negativos. Esta estructura se repite periódicamente en todas las direcciones del cristal, lo que resulta en un arreglo altamente ordenado y simétrico de los iones.
Tipos
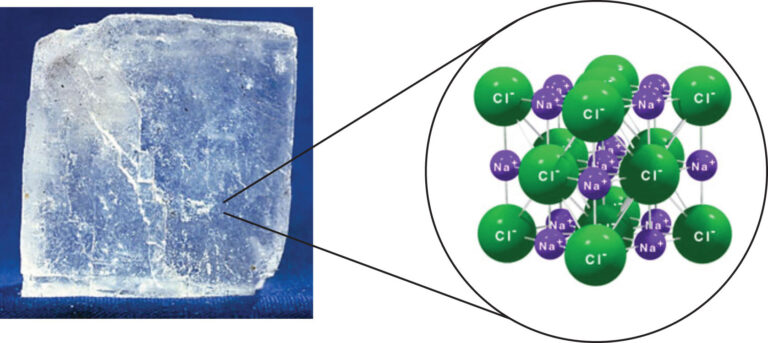
- Cúbica: En una estructura cúbica, los iones positivos y negativos se organizan en una red tridimensional de celdas cúbicas. Este tipo de estructura es común en muchos compuestos iónicos, como el cloruro de sodio (NaCl).
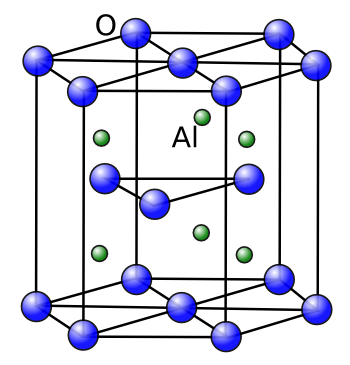
- Hexagonal: En una estructura hexagonal, los iones positivos y negativos se organizan en una red tridimensional de celdas hexagonales. Ejemplos de compuestos con esta estructura incluyen el óxido de aluminio (Al2O3).
- Ortorrómbica: En una estructura ortorrómbica, los iones positivos y negativos se organizan en una red tridimensional de celdas ortorrómbicas. Ejemplos de compuestos con esta estructura incluyen el sulfato de magnesio (MgSO4).
- Empaquetamiento Compacto: Las redes cristalinas tienden a adoptar configuraciones que minimizan la energía y maximizan el empaquetamiento de los iones. Esto puede resultar en estructuras cristalinas densas y compactas.
Energía Reticular
Esta energia es una medida de la fuerza de los enlaces iónicos en una red cristalina y representa la energía necesaria para separar completamente todos los iones en un mol de compuesto iónico sólido y llevarlos a una distancia infinita. Esta energía es una medida de la estabilidad de la red cristalina y está relacionada con la fuerza de las fuerzas electrostáticas entre los iones.
Características
- Dependencia de la Distancia: La energía reticular disminuye a medida que la distancia entre los iones aumenta. Esto se debe a que las fuerzas electrostáticas entre los iones disminuyen con la distancia y se vuelven más débiles a medida que los iones se alejan entre sí.
- Dependencia del Tamaño y Carga de los Iones: Esta energía también depende del tamaño y la carga de los iones en la red cristalina. Cuanto mayor sea la carga de los iones y cuanto más pequeños sean sus radios iónicos, mayor será la energía reticular.
- Influencia en las Propiedades Físicas: La energía reticular influye en muchas propiedades físicas de los compuestos iónicos, como el punto de fusión y la solubilidad. Los compuestos con una alta energía reticular generalmente tienen puntos de fusión más altos y son menos solubles en disolventes polares como el agua.
- Relación con la Estabilidad: Esta está relacionada con la estabilidad de la red cristalina. Cuanto mayor sea la energía reticular, más estable será la red cristalina y más difícil será romper los enlaces iónicos en el compuesto.
Cálculo de la Energía Reticular
La energía reticular se puede calcular utilizando la ley de Coulomb para calcular la energía potencial electrostática entre los iones en la red cristalina. Esta energía se expresa generalmente en julios por mol (J/mol) o kilojulios por mol (kJ/mol).
Aplicaciones
- Es útil para comprender y predecir las propiedades físicas y químicas de los compuestos iónicos, como su solubilidad, dureza y conductividad eléctrica.
- También es importante en la industria y la tecnología, donde se utilizan compuestos iónicos en aplicaciones como la fabricación de cerámicas, materiales semiconductores y electrolitos en baterías.