¿QUÉ ES UN ENLACE QUÍMICO?
Es la fuerza que mantiene unidos a los átomos en una molécula o en un cristal. Estos enlaces surgen de la interacción entre los electrones de los átomos. Según la teoría de la mecánica cuántica, los electrones se distribuyen en niveles de energía alrededor del núcleo del átomo, y estos niveles están organizados en capas electrónicas.
Clasificación
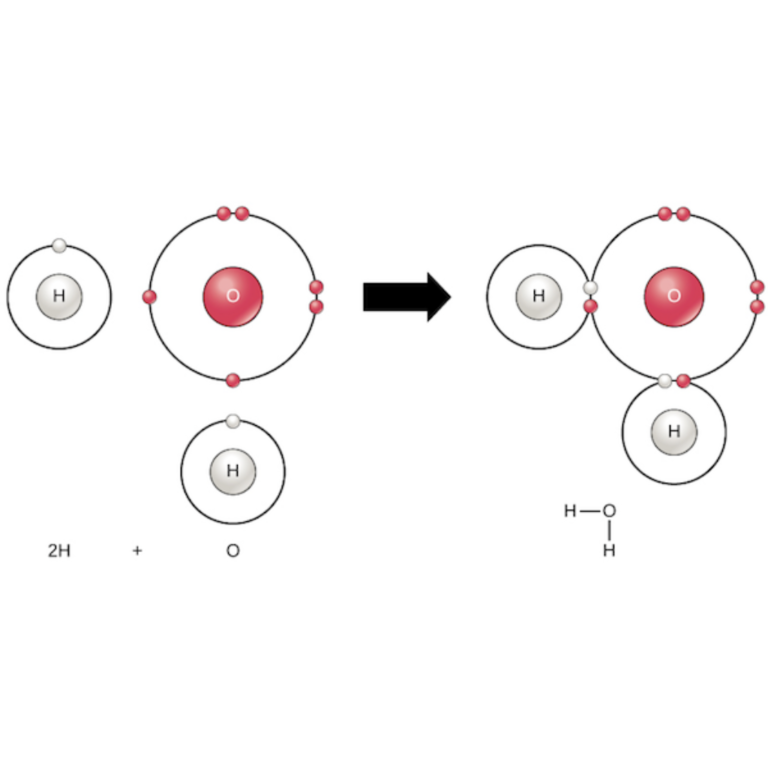
- Enlace Covalente: Los átomos comparten pares de electrones para alcanzar la estabilidad.
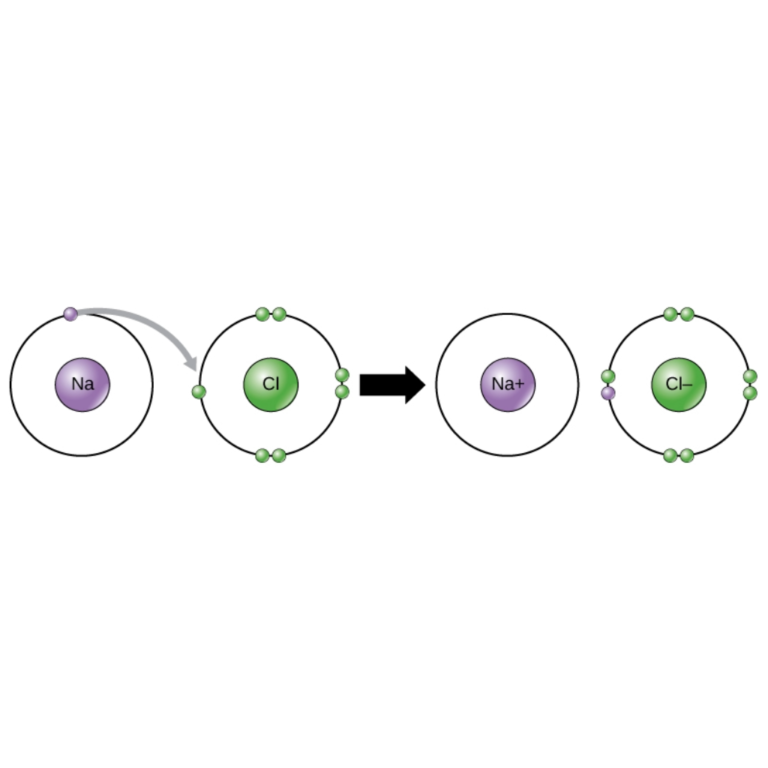
Por ejemplo, en la molécula de agua (H2O), los átomos de hidrógeno comparten electrones con el átomo de oxígeno. - Enlace Iónico: Aquí, los átomos transfieren electrones para formar iones cargados que se atraen entre sí.
Por ejemplo, en el cloruro de sodio (NaCl), el átomo de sodio transfiere un electrón al átomo de cloro, formando iones Na+ y Cl- que se unen mediante fuerzas electrostáticas. - Enlace Metálico: Característico de los metales, en este tipo de enlace los electrones se mueven libremente entre los átomos, formando una “nube electrónica” que mantiene unidos a los iones metálicos. Esto confiere propiedades como la conductividad eléctrica y térmica.
Aplicaciones y limitaciones de la regla del octeto
Aplicaciones
Es un principio fundamental en la química que establece que muchos átomos tienden a reaccionar formando compuestos de manera que adquieran una configuración electrónica similar a la de los gases nobles, es decir, con ocho electrones en su capa de valencia.
- Predicción de la formación de enlaces: Es útil para predecir cómo los átomos se unirán entre sí para formar compuestos.
Por ejemplo, cuando un átomo comparte, gana o pierde electrones para alcanzar ocho electrones en su capa de valencia, puede formar enlaces covalentes o iónicos. - Diseño de estructuras moleculares: Ayuda a entender la geometría y la estructura de las moléculas.
Por ejemplo, en las moléculas diatómicas como el oxígeno (O2) y el nitrógeno (N2), ambos átomos comparten electrones para alcanzar la configuración del gas noble. - Explicación de propiedades químicas: Explica algunas propiedades químicas de los elementos y compuestos.
Por ejemplo, los elementos que forman enlaces covalentes simples tienden a tener puntos de fusión y ebullición relativamente bajos, ya que los enlaces covalentes son débiles en comparación con los enlaces iónicos o metálicos.
Limitaciones
- Excepciones: Hay numerosos casos en los que los átomos no siguen estrictamente la Regla del Octeto. Por ejemplo, en el ácido bórico (H3BO3), el boro tiene solo seis electrones de valencia en lugar de ocho. Otro ejemplo es el ion hipoclorito (ClO-), donde el cloro tiene siete electrones en lugar de ocho.
- Compuestos con capas de valencia extendidas: Algunos átomos pueden expandir su capa de valencia para acomodar más de ocho electrones. Este fenómeno se observa en elementos del tercer período o posteriores en la tabla periódica, como el fósforo en el pentóxido de fósforo (P2O5).
- Enlaces con electrones desapareados: Algunos compuestos pueden tener átomos con un número impar de electrones, lo que resulta en la presencia de electrones no apareados. Estos compuestos pueden ser inestables y altamente reactivos, como el radical hidroxilo (•OH).
Aunque tiene sus limitaciones, sigue siendo una herramienta útil para entender y predecir el comportamiento de los elementos y compuestos en la química, aunque en muchos casos es necesario considerar excepciones y extensiones.
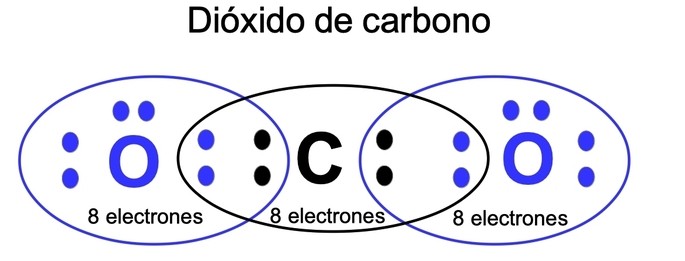
Un ejemplo clásico que ilustra esta regla es el dióxido de carbono (CO2). En esta molécula, cada átomo de oxígeno comparte dos pares de electrones con el átomo de carbono, cumpliendo así con la regla del octeto tanto para el carbono como para el oxígeno. Sin embargo, el átomo de carbono también puede ser un ejemplo de cómo algunos elementos pueden exceder el octeto, ya que tiene una configuración electrónica expandida molecular.
CUESTIONARIO ENLACES QUÍMICOS