¡Bienvenidos al fascinante mundo de los enlaces químicos!
Aquí encontrarás todo lo que necesitas saber sobre uno de los conceptos fundamentales en química:
los ENLACES COVALENTES.
Exploraremos cómo los átomos comparten electrones para formar moléculas estables y las fascinantes propiedades que surgen de estas interacciones.
¿Qué son los enlaces covalentes?
Es un tipo de enlace químico en el cual dos átomos comparten uno o más pares de electrones para alcanzar configuraciones electrónicas estables. Este tipo de enlace es común en moléculas formadas por átomos no metálicos.
Características de los enlaces covalentes
- Compartición de Electrones: Los átomos comparten uno o más pares de electrones para formar un enlace entre ellos. Este proceso ocurre cuando los átomos tienen una diferencia de electronegatividad relativamente pequeña.
- Formación de Moléculas: Son responsables de la formación de moléculas. Los átomos se unen entre sí mediante enlaces covalentes para alcanzar la configuración electrónica de gas noble, que generalmente implica tener ocho electrones en la capa de valencia.
- Tipos de Enlaces Covalentes: Pueden ser simples, dobles o triples, dependiendo del número de pares de electrones compartidos entre los átomos. En un enlace simple, dos átomos comparten un par de electrones; en un enlace doble, comparten dos pares de electrones; y en un enlace triple, comparten tres pares de electrones.
- Geometría Molecular: La geometría está determinada por la disposición de los átomos y los pares de electrones alrededor del átomo central. Esta geometría está influenciada por la repulsión entre los pares de electrones enlazantes y no enlazantes, según la teoría de repulsión de pares de electrones de la capa de valencia (RPCEV).
Ejemplos de compuestos con enlaces covalentes
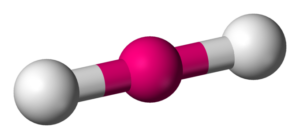
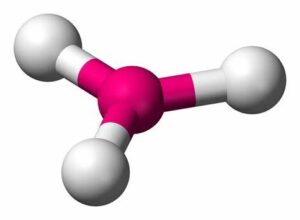
- Agua (H2O): El agua está formada por dos átomos de hidrógeno y un átomo de oxígeno unidos mediante enlaces covalentes. El oxígeno comparte un par de electrones con cada átomo de hidrógeno, formando dos enlaces covalentes simples.
- Dióxido de Carbono (CO2): El dióxido de carbono está compuesto por un átomo de carbono y dos átomos de oxígeno unidos mediante enlaces covalentes dobles. El carbono comparte dos pares de electrones con cada átomo de oxígeno.
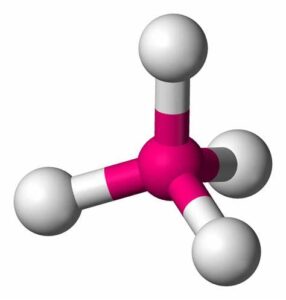
- Metano (CH4): El metano está formado por un átomo de carbono y cuatro átomos de hidrógeno unidos mediante enlaces covalentes simples. El carbono comparte un par de electrones con cada átomo de hidrógeno.
Teorías para explicar los enlaces covalentes
Teoría de Enlace de Valencia (TEV)
Propuesta por Linus Pauling en 1931, postula que los átomos comparten electrones para formar enlaces covalentes mediante la superposición de orbitales atómicos.
Según esta teoría, los átomos pueden formar enlaces covalentes cuando sus orbitales se solapan, permitiendo que los electrones compartidos residan en una región espacial entre los núcleos de los átomos enlazados.
La TEV es útil para predecir la geometría molecular y explicar la naturaleza de los enlaces covalentes en términos de la hibridación de orbitales atómicos.
Teoría del enlace de orbitales moleculares (TEOM)
Propuesta por primera vez por Friedrich Hund y Robert Mulliken en la década de 1930, describe los enlaces covalentes en términos de la combinación de orbitales atómicos para formar orbitales moleculares.
Según esta teoría, los electrones se distribuyen en orbitales moleculares que pertenecen a toda la molécula en lugar de estar localizados en átomos individuales.
La TEOM explica fenómenos como la delocalización electrónica y proporciona una descripción más completa de las propiedades de enlace y la reactividad de las moléculas.
Teoría de Resonancia
Esta teoría sugiere que en algunas moléculas, la estructura real es una combinación o mezcla de varias estructuras de Lewis, conocidas como estructuras de resonancia, las cuales tienen la misma disposición de átomos pero con diferentes distribuciones de electrones.
La verdadera estructura de la molécula es una combinación de todas estas estructuras de resonancia, útil para explicar la estabilidad y reactividad de muchas moléculas orgánicas e inorgánicas que no pueden ser explicadas completamente por una única estructura de Lewis.
Estas teorías proporcionan diferentes enfoques para comprender y explicar el enlace covalente y sus propiedades. Cada una tiene sus fortalezas y limitaciones, y juntas proporcionan una descripción más completa de la naturaleza del enlace químico en las moléculas.
Teorías del enlace de valencia.
Las teorías del enlace de valencia (TEV) son un conjunto de modelos que explican la formación de enlaces químicos entre átomos en términos de la superposición de orbitales atómicos y la compartición de electrones. Estas teorías surgieron en el siglo XX y han sido fundamentales para comprender la naturaleza de los enlaces químicos, especialmente los enlaces covalentes.
Principios básicos
- Compartición de Electrones: Los enlaces químicos se forman cuando dos átomos comparten uno o más pares de electrones. Estos electrones compartidos residen en una región espacial entre los núcleos de los átomos enlazados.
- Superposición de Orbitales Los átomos utilizan sus orbitales atómicos (s, p, d, etc.) para formar enlaces. La superposición de estos orbitales crea nuevos orbitales híbridos que tienen formas y energías diferentes a los orbitales atómicos originales.
- Estructura de Lewis: La TEV se basa en la estructura de Lewis, que utiliza símbolos y puntos para representar los electrones de valencia de los átomos y los enlaces entre ellos. La estructura de Lewis proporciona una representación visual de cómo se comparten los electrones en una molécula.
Aplicaciones de las TEV
- Predicción de la Geometría Molecular: Son útiles para predecir la geometría y la forma de las moléculas basadas en la disposición de los enlaces covalentes y los pares de electrones no enlazantes alrededor del átomo central.
- Explicación de la Polaridad Molecular: Ayudan a entender la polaridad de las moléculas, donde las diferencias en la electronegatividad entre los átomos que forman enlaces covalentes conducen a la formación de dipolos eléctricos.
- Estabilidad y Reactividad de Compuestos: Proporcionan una descripción de cómo se forman y rompen los enlaces químicos en reacciones químicas, lo que permite predecir la estabilidad y la reactividad de los compuestos.
Hibridación y geometría molecular
Hibridación
Geometría molecular
Teoría del orbital molecular
Principios fundamentales
- Combinación de Orbitales Atómicos: La TOM postula que los electrones en una molécula no están restringidos a los orbitales atómicos de los átomos individuales, sino que se distribuyen en orbitales moleculares que se extienden sobre toda la molécula. Estos orbitales son el resultado de la combinación lineal de los orbitales atómicos de los átomos enlazados.
- Formación de Orbitales Moleculares: Durante la formación de enlaces covalentes, los orbitales atómicos de los átomos que se unen se superponen y combinan para formar nuevos orbitales moleculares. Dependiendo de la fase relativa de los orbitales atómicos, los orbitales moleculares pueden ser de unión (que tienen una mayor densidad electrónica entre los núcleos) o de antiunión (que tienen una densidad electrónica baja o nula entre los núcleos).
- Distribución Electrónica: Los electrones en una molécula ocupan los orbitales moleculares disponibles de menor energía de acuerdo con el principio de exclusión de Pauli y el principio de Aufbau. La configuración electrónica resultante determina las propiedades de enlace y las características de la molécula, como su geometría y reactividad.
Aplicaciones de la TOM
- Predicción de Propiedades Moleculares: Es útil para predecir y explicar propiedades moleculares como la geometría, la polaridad y la reactividad química de las moléculas.
- Interpretación de Espectroscopía: Es fundamental para interpretar datos espectroscópicos, como espectros de absorción y emisión, ya que los estados electrónicos y las transiciones entre orbitales moleculares están directamente relacionados con estas observaciones.
- Estudio de la Reacción Química: Proporciona una descripción detallada de cómo ocurren las reacciones químicas, incluida la formación y ruptura de enlaces, a través de cambios en los orbitales moleculares y la distribución de electrones.